Орлова Вера Александровна — доктор медицинских наук, профессор, главный научный сотрудник Московского научно-исследовательского института психиатрии — филиала ФГБУ «ФМИЦПН» Минздрава России;
Герасимова Ольга Валерьевна — клинический психолог клиники «Психическое здоровье»;
Михайлова Ирина Иосифовна — кандидат медицинских наук, ведущий научный сотрудник Московского научно-исследовательского института психиатрии — филиала ФГБУ «ФМИЦПН» Минздрава России;
Минутко Виталий Леонидович — доктор медицинских наук, профессор, руководитель клиники «Психическое здоровье»;
Гнездицкий Виктор Васильевич — доктор биологических наук, профессор, руководитель лаборатории клинической нейрофизиологии ФГБУ «Научный центр неврологии» РАМН, председатель секции клинической электроэнцефалографии при Московском нейрофизиологическом обществе, вице-президент Ассоциации клинических нейрофизиологов России;
Журнал "Социальная и клиническая психиатрия" Том 27, выпуск 1
В многочисленных исследованиях были продемонстрированы аномалии слуховых вызванных потенциалов (ВП) при шизофрении, свидетельствующие о нарушениях процессов сенсорного входа, обновления информации, поддержания ресурсов внимания и др. [3, 13, 15−17 и др.]. Наиболее полно при шизофрении изучены параметры P300: снижение амплитуды и удлинение латентного периода этого компонента неоднократно описывалось исследователями [12]. Демонстрировалась сопряженность аномалий амплитуды P300 с выраженностью психопатологической симптоматики, возрастом манифестации заболевания [4, 6, 18], редукцией мозговых структур [5 и др.].
Вместе с тем, несмотря на длительную историю изучения, тонкие механизмы, обусловливающие аномалии ВП при шизофрении, остаются нераскрытыми. Как известно, генерация ВП зависит от функции нейромедиаторов и синаптических рецепторов. Поэтому важным направлением исследований должно явиться изучение причин, приводящих к нарушению этой функции. Известно, что функция медиаторов и работа клеточных рецепторов могут изменяться вирусами и специфическими противовирусными антителами по закономерностям молекулярной мимикрии [8]. В ряде исследований было показано участие нейротропных вирусов группы герпеса в патогенезе заболевания [7, 19, 23, 24 и др.]. В отдельных работах у больных шизофренией были установлены корреляции уровня сывороточных антител к этим вирусам с тяжестью психопатологической симптоматики [7, 19], степенью редукции мозговых структур [19, 21], а также выраженностью сосудистой патологии [19].
Изложенное явилось основанием для проведения исследования взаимосвязей между характеристиками слуховых ВП и уровнем сывороточных антител к герпесвирусам у больных шизофренией.
Материал и методы
Было обследовано 48 больных приступообразной шизофренией (24 муж. и 24 жен.). Диагностика осуществлялась по классификации НЦПЗ РАМН и МКБ-10, в соответствии с чем у 16 человек (7 муж., 9 жен., средний возраст 34±10 лет) была установлена неблагоприятно протекающая приступообразная форма заболевания с тенденцией к переходу в непрерывное течение с сохранением редуцированной параноидной симптоматики в ремиссиях, стабильным и нарастающим дефектом (F20.00−01) (I группа), у 16 человек (9 муж., 7 жен., средний возраст 33±11л.) — приступообразно-прогредиентная (F20.01−02) с ремиссиями более высокого качества с сохранением рудиментарных субпсихотических проявлений, нарастающим и стабильным дефектом (II группа), и у 16 человек (8 муж., 8 жен., средний возраст 28±8 л.) — рекуррентная (F20.03) (III группа). Средняя длительность заболевания с момента его манифестации с учетом всей выборки составила 7±8 лет. Первая и вторая группы пациентов рассматривались в качестве основных, третья — в качестве контрольной.
Все больные обследовались в состоянии экзацербации параноидной симптоматики. По оценке состояния на момент обследования галлюцинаторно-бредовые синдромы чаще наблюдались у больных двух основных групп приступообразно-прогредиентной шизофрении, достигая максимума во второй неблагоприятной группе (43,8% против 12,5% у больных контрольной группы). Аффективно-бредовые состояния, напротив, являлись превалирующими в группе больных рекуррентной шизофренией: 75% против 31,2% у больных первой неблагоприятной группы приступообразно-прогредиентной шизофренией. В последней упомянутой группе по сравнению с другими группами чаще всего выявлялись кататонические синдромы (43,8%).
При оценке психопатологических расстройств использовались данные шкалы BPRS. По общему баллу шкалы между исследованными группами различий не было. Вместе с тем, в контрольной группе отмечалась большая выраженность симптомов, свидетельствующих об остроте бредового состояния. Они проявлялись в параметрах нарушения поведения («возбуждение», «враждебность»), бредовых расстройств («подозрительность», «идеи величия») и «концептуальной дезорганизации», достигая статистически значимых различий (p<0,05) по двум последним блокам психопатологических расстройств. Тяжесть галлюцинаторной симптоматики в этой группе была меньше, и обнаруживала достоверные различия при сравнении с неблагоприятной группой приступообразно-прогредиентной шизофрении (p<0,05). Исследование вызванных потенциалов (ВП) проводилось на приборе фирмы Нейрософт Нейро-МВП-4 (Иваново). Изучались параметры латентности (ЛП) и амплитуды (А) слуховых когнитивных ВП (СКВП, Р300) и латентности длиннолатентных слуховых ВП (ДСВП). Для когнитивных ВП (КВП) проводилась стимуляция в виде щелчков с тоновым наполнением — для незначимых стимулов 1000 Гц, для значимых 2000 Гц длительностью 40 мс интенсивностью 85 дБ. При исследовании КВП (Р300) имела место когнитивная задача: испытуемый должен был посчитать число значимых щелчков более высоким тоном (2 000 Гц) и нажать при этом на кнопку. Соотношение незначимых и значимых стимулов 7/3. Для незначимых стимулов частота составляла 1,2 Гц. Значимый стимул возникал случайно с вероятностью в 30%. Электроды располагались по системе 10−20%. Активные электроды С3, C4 (или Cz), референты располагались на правом и левом мастоидах, в отведениях (С3-М1 и С4-М2 с ипсилатеральными мастоидами) заземляющий электрод на лобном полюсе — электрод Fpz. Число усреднений для значимого стимула — от 15 до 30. Для ДСВП: активный электрод Сz, референт — объединенный мастоид. Число усреднений — 100. Полоса частот в обеих методиках составляла 0,2−30 Гц.
На рисунке показан пример выделения КВП (Р300) и ДСВП (ответы на незначимый стимул) у здорового испытуемого и компоненты, используемые для анализа.
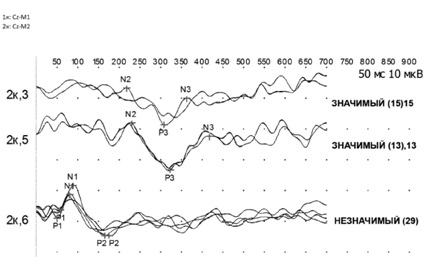
|
Стимул |
Канал |
Комм. |
Компонент |
Лат., ммс |
Норма, ммс |
Откл., % |
||
|
|
||||||||
|
оба уха 80 дБ 40 мс |
1 |
значимый (15)15 |
N2 |
218 |
|
|
||
|
модулир. f=2000 Гц |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P3 |
307 |
390 |
(N) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N3 |
363 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
значимый (13),13 |
N2 |
230 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P3 |
323 |
390 |
(N) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N3 |
418 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
оба уха 80 дБ 40 мс |
1 |
незначимый (29) |
N1 |
87,5 |
|
|
||
|
модулир. f=1000 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
незначимый (29) |
N1 |
79,7 |
|
|
||
|
Стимул
|
Ка- нал |
Комм.
|
Компо- ненты |
Ампл., мкВ(/) |
|
оба уха 80 дБ 40 мс |
1 |
значимый (15)15 |
N2-P3 |
12 |
|
модулир. f=2000 Гц |
||||
|
|
|
|
|
|
|
|
|
|
P3-N3 |
8,62 |
|
|
|
|
|
|
|
|
2 |
значимый (13),13 |
N2-P3 |
15,4 |
|
|
|
|
|
|
|
|
|
|
P3-N3 |
11,1 |
|
|
|
|
|
|
|
оба уха 80 дБ 40 мс |
1 |
незначимый (29) |
N1-P2 |
16,3 |
|
модулир. f=1000 Гц |
||||
|
|
|
|
|
|
|
|
2 |
незначимый (29) |
N1-P2 |
13,5 |
Уровень сывороточных антител (АТ) (IgM, ядерные IgG) к вирусам группы герпеса (вирусу простого герпеса первого типа — ВПГ-1, вирусу простого герпеса второго типа — ВПГ-2, вирусу Эпштейна-Барр — ВЭБ, цитомегеловирусу — ЦМВ) определялся методом твердофазного ИФА с применением моно-клональных антител.
Корреляции между параметрами ВП, клиническими и серологическими параметрами определялись путем вычисления коэффициента ранговой корреляции Spearman ® при уровне достоверности p≤0,05. Достоверность межгрупповых различий вычислялась с использованием Mann-Whitney U-test при р≤0,05.
Результаты
Как видно из табл. 1, средние значения латентных периодов и амплитуд слуховых ВП в исследованных группах больных обнаруживали аномалии, отличаясь от нормативных показателей. Латенции ранних компонентов СКВП обнаруживали как укорочение (в большей степени при неблагоприятной форме течения у больных первой основной группы), так и удлинение (в большей степени у больных приступообразно-прогредиентной шизофренией). Ранее укорочение латентного периода ВП в неврологической клинике отмечалось при воспалительных процессах в мозге [2], которые обсуждаются также при шизофрении [11, 20 и др.]. Следует отметить, что латенции ДСВП P1 и N1 превышали норму более, чем в 2 раза. Показатели исследованных ВП выявляли достоверное межгрупповое различие по U-test для параметров латенций N2 СКВП и P1 ДСВП при сравнении групп приступообразно-прогредиентной и рекуррентной шизофрении, для латенции P2 СКВП при сравнении первой и второй основных групп. Амплитуды СКВП выявляли как снижение (чаще при самой тяжелой форме течения у больных первой группы), так и увеличение (у больных второй группы). Амплитуды N1 — Р2 ДСВП достоверно различались по U-test у больных первой и второй групп.
|
Показатель ВП |
ВП |
нормативные данные |
приступообразно-прогредиентная с тенденцией к непрерывному течению |
приступообразно-прогредиентная шизофрения |
рекуррентная шизофрения (контрольная группа) |
|
Латентности когнитивных ВП (мс) |
P1 |
|
40,45 ±19,49 |
53,85± 18,51 |
42,47± 12,21 |
|
N1 |
94±8 |
90,82± 29,3 |
119,5± 19,27 |
97,4± 11,81 |
|
|
P2 |
168±19 |
145± 34,54** |
172,8± 22,76 |
163± 22,49 |
|
|
N2 |
|
211,8 ± 29,73* |
234± 21,29 |
219,5± 16,62 |
|
|
P3 |
|
318,5± 29,45 |
332± 26,49 |
321,6± 31,91 |
|
|
N3 |
310±21 |
476 ± 29,78 |
512,8± 60,69 |
487,9± 37,65 |
|
|
Амплитуды когнитивных ВП (мкВ) |
Р1-N1 |
|
6,73± 4,788 |
7,941± 3,12 |
7,287± 3,214 |
|
N1-P2 |
8.6±5.56 |
5,909± 4,224** |
10,45± 4,831 |
7,969± 2,846 |
|
|
P2-N2 |
|
6,06± 3,922 |
6,368± 3,932 |
5,015± 3,062 |
|
|
N2-P3 |
|
7,746± 4,012 |
8,934± 5,589 |
8,862± 7,264 |
|
|
Латентности длиннолатентных ВП (мс) |
P1 |
40-70 мс |
161,5± 18,16* |
164,8± 17,8 |
143,3± 17,52 |
|
N1 |
90-110 мс |
196,5± 22,92 |
194,3± 21,63 |
181,3± 19,38 |
|
|
P2 |
180-220 мс |
189± 26,47 |
223,7± 19,09 |
214,3± 17,52 |
|
|
N2 |
более 220 мс |
271± 35,93 |
270,8± 41,32 |
258,3± 24,42 |
|
|
P3 |
|
312,2± 14,84 |
305,3± 27,08 |
277,3± 18,46 |
Примечания: * – p<0,05 при сравнении больных II и III групп , ** – p<0,05 при сравнении больных I и II групп; *** – по данным D.S.Goodin и K.S.Squires [14] по группе здоровых испытуемых в возрасте от 16 до 76 лет и по данным [10].
Средние значения уровней АТ к вирусам герпеса как в двух основных группах, так и в контрольной группе рекуррентной шизофрении, превышали нормативные для IgG к ВЭБ (табл. 2). В первой группе неблагоприятно протекающей приступообразно-прогредиентной шизофрении был существенно повышен по сравнению с референтными показателями и уровень IgМ к этому вирусу. В контрольной группе отмечалось максимальное превышение нормативных показателей по IgG к ВПГ-1 по сравнению с больными двух основных групп, и минимальное — к ВЭБ. Вторая основная группа занимала по указанным показателям промежуточное положение. Выявленные во всех обследованных группах пациентов ненулевые значения IgM ко всем герпес-вирусам указывали, в соответствии с современными методами диагностики [1], на наличие острой инфекции.
|
Ig (Ед/мл) |
Референтные значения |
Среднее значение и стандартное отклонение |
||
|
Приступообразно-прогредиентаная шизофрения с тендецией к непрерывному течению |
Приступообразно-прогредиентная шизофрения |
Рекуррентная шизофрения (контрольная группа) |
||
|
IgG к ВПГ-1 |
<9 - отр. >9,8 –пол. |
13,5 +12,3 |
12,4 + 8,5 |
14,4 + 9,1 |
|
IgM к ВПГ-1 |
<1 – отр. >1 - пол. |
0,6+0,4 |
0,8 + 0,1* |
0,8 + 0,1 |
|
IgG к ВПГ-2 |
<6 – отр. >6,8 – пол. |
2,7+2,7 |
2 + 1,2** |
3,5 + 2,5 |
|
IgM к ВПГ-2 |
<1 – отр. >1 – пол. |
0,6+0,3 |
0,7 + 0,2 |
0,8 + 0,2 |
|
IgM к ЦМВ |
<0,9 – отр. >1,1 – пол. |
0,7+0,1 |
0,6 + 0,4 |
0,8 + 0,2 |
|
IgG к ЦМВ |
<6 – отр. >6 – пол. |
5,1+1,7 |
5,3 + 4,7 |
6,2 +4,5 |
|
IgG к ВЭБ |
<1 – отр. >1 – пол. |
4,9+ 3,3 |
5 + 2,9 |
4,6 + 2,6 |
|
IgM к ВЭБ |
<1 – отр. >1 – пол. |
1,3+1,4 |
0,8 + 0,1 |
0,8 + 0,04 |
Примечания: * – p<0,05 при сравнении больных II групп и III групп, ** – p<0,05 при сравнении больных I и III групп.
В различных группах исследованных пациентов были установлены корреляции ЛП и амплитуд изученных ВП с клиническими характеристиками заболевания (табл. 3). Максимальное число корреляций было обнаружено у больных неблагоприятно протекающей приступообразно-прогредиентной шизофренией.
| Параметр слуховых ВП | Приступообразно-прогредиентная шизофрения с тендецией к непрерывному течению | Приступообразно-прогредиентная шизофрения | Рекуррентная шизофрения | ||||
| Параметр BPRS | R | Параметр BPRS | R | Параметр BPRS | R | ||
| ЛП КВП Р1 | Моторная заторможенность | -0,73 | |||||
| ЛП КВП N1 | Моторная заторможенность | -0,67 | Депрессивное настроение | -0,59 | |||
| Галлюцинации | -0,56 | ||||||
| ЛП КВП Р2 | Моторная заторможенность | -0,62 | Тревога | -0,63 | Подозрительность | -0,54 | |
| Напряженность | -0,64 | ||||||
| ЛП КВП Р3 | Соматическая озабоченность | 0,66 | Соматическая озабоченность | -0,66 | |||
| Тревога | 0,64 | ||||||
| Общий балл | 0,66 | ||||||
| А КВП P1 – N1 | Концептуальная дезорганизация | -0,65 | Галлюцинации | 0,56 | Тревога | -0,58 | |
| Манерность и поза | 0,59 | ||||||
| Депрессивное настроение | -0,53 | ||||||
| А КВП N1–P2 | Подозрительность | 0,67 | Манерность и поза | 0,65 | Общий балл | 0,66* | |
| А КВП P2 – N2 | Тревога | -0,57 | |||||
| А КВП N2–P3 | Галлюцинации | -0,69 | |||||
| Дезориентация | -0,72 | ||||||
| ЛП ДСВП Р1 | Общий балл | 0,92* | |||||
| ЛП ДСВП N1 | Галлюцинации | 0,88 | Депрессивное настроение | 0,71 | |||
| Дезориентация | 0,91 | ||||||
| Общий балл | 0,93* | ||||||
| ЛП ДСВП Р2 | Напряженность | 0,93* | |||||
| Галлюцинации | 0,89 | ||||||
| Дезориентация | 0,98** | ||||||
| Общий балл | 0,81 | ||||||
| ЛП ДСВП N2 | Напряженность | 0,85 | Манерность и поза | 0,74* | |||
| ЛП ДСВП Р3 | Напряженность | 0,61 | |||||
| Манерность и поза | 0,71* | ||||||
| Депрессивное настроение | 0,63 | ||||||
| Дезориентация | 0,64 | ||||||
Примечания: * – р<0,01; ** – р<0,005.
Корреляции характеристик изученных ВП с уровнем противогерпетических АТ варьировали от 0,6 до 0,9 (табл. 4). Они обнаруживались во всех исследованных группах пациентов и наиболее часто выявлялись при менее благоприятных формах течения заболевания.
|
Параметр слуховых ВП |
Приступообразно-прогредиентная шизофрения с тенденцией к непрерывному течению |
Приступообразно-прогредиентная шизофрения |
Рекуррентная шизофрения |
|||
|
АТ |
R |
АТ |
R |
АТ |
R |
|
|
ЛП КВП Р1 |
|
|
|
IgG к ВПГ-2 |
-0,7** |
|
|
ЛП КВПN2 |
|
IgG к ВПГ-2 |
-0,6 |
|
||
|
ЛП КВП P3 |
IgG к ВПГ-1 |
0,72* |
|
|||
|
ЛП КВП Р2 |
0,65 |
IgМ к ВЭБ |
0,59 |
|
|
|
|
ЛП КВП N3 |
|
IgG к ЦМВ |
0,56 |
IgМ к ВПГ-1 |
-0,53 |
|
|
А КВП N1–P2 |
IgG к ВЭБ |
0,63 |
|
|||
|
IgG к ЦМВ |
0,71 |
|||||
|
А КВП P2– N2 |
IgG к ЦМВ |
-0,9** |
IgG к ВЭБ |
0,81** |
||
|
ЛП ДСВП Р1 |
IgG к ВЭБ |
0,9 |
IgМ к ВПГ-2 |
0,73 |
||
|
ЛП ДСВП Р2 |
IgМ к ЦМВ |
0,82 |
|
IgМ к ВПГ-1 |
-0,62 |
|
|
ЛП ДСВП Р3 |
|
IgG к ВПГ-2 |
0,78 |
|
||
|
|
IgG к ЦМВ |
-0,68 |
|
|
||
Примечания: * – р<0,01; ** – р<0,005, во всех остальных случаях – р<0,05.
Обсуждение
Проведенное исследование выявило корреляции характеристик СКВП и ДСВП с психопатологической симптоматикой у больных шизофренией, что находится в соответствии с имеющимися в литературе данными. В частности, установленные корреляции между амплитудой СКВП N2-P3 и выраженностью таких симптомов, как галлюцинации и дезориентация, подтверждают ранее опубликованные данные о взаимосвязи амплитуды слуховых P3 с тяжестью позитивных психопатологических расстройств (6, 18 и др.). Последние, как и в некоторых других исследованиях шизофрении (4), также обнаруживали корреляции с характеристиками латенций N1 и P2 и амплитуд N1, N2 СКВП.
В группе неблагоприятно текущей приступообразно-прогредиентной и контрольной группе рекуррентной шизофрении было выявлено уменьшение амплитуды N1-P2 СКВП на слуховые стимулы при выполнении когнитивной задачи на обнаружение стимулов заданной частоты, коррелирующее с параметрами «подозрительность» в первой и «общий балл шкалы BPRS» в контрольной группах. Снижение амплитуды ранних ответов ВП может быть проинтерпретировано как утрата новизны стимула. Полученные результаты согласуются с данными, выявляющими корреляции характеристик ВП и особенностей внимания при шизофрении [9].
В доступной нам литературе не удалось обнаружить исследований по взаимосвязям характеристик ДЛСВП и психопатологических расстройств при шизофрении. Увеличение латенций ДЛСВП у обследованных больных прямо и достоверно коррелирует как с психотической, так и с депрессивной симптоматикой. Можно предположить, что для восприятия слухового стимула пациентам требуется больше времени в связи с необходимостью переключиться с психотических переживаний на восприятие реального стимула. Депрессивное настроение связано и с торможением когнитивной деятельности в целом. Отражая суммарную биоэлектрическую активность различных нейронных сетей головного мозга, ВП, как известно, занимают промежуточное положение между субстратом головного мозга и его функциями, проявляющимися поведенческими и клиническими характеристиками [22]. Патогенетическим связующим звеном, которое приводит к генерации продуктивной симптоматики, может выступать взаимодействие вируса, а также противовирусных антител с нейроном. Как известно, динамика патологических изменений клеточно-тканевых структур, в частности, клеток нервной ткани, в процессе взаимодействия с вирусным агентом, развертывается в направлении вовлечения вируса в работу рецепторного аппарата клетки за счет сходства его эпитопов и эпитопов клеточных рецепторов с последующим проникновением вируса внутрь клетки и нарушением синтеза клеточных ДНК и РНК. IgG, направленные против вирусных факторов, а в связи с явлением молекулярной мимикрии и против собственных структур, как известно, являются высокопермеабельными молекулами. Они проходят через все гистогематические барьеры против градиентов концентрации, а также через мембраны клеток, включая ядерные. Проникновение в ткани мозга противогерпетических антител сопряжено с влиянием на клеточные структуры, включая нейрональные рецепторы, комплексов АГ-АТ, запускающих дальнейший каскад изменений в тканях, в том числе аутоиммунные процессы. Интоксикация, сопровождающая инфекцию, меняет проницаемость клеточных мембран, что способствует нарушению синаптической передачи. Усложнение и утяжеление этих процессов связано с повреждением герпесвирусами эндотелия сосудов, что приводит к повышению проницаемости гематоэнцефалического барьера, способствующего дальнейшему проникновению инфектов в мозг.
Впервые выявленные взаимосвязи между характеристиками исследованных ВП и уровнем антител к герпесвирусам свидетельствуют о возможности модификации ими работы нейронных популяций. В частности, в увеличение латентного периода СКВП, свидетельствующее о замедлении начала процесса ответа на стимул, вносят вклад в разных обследованных группах больных антитела к ВПГ-1, ВЭБ и ЦМВ. Удлинение латентностей ДСВП сопряжено с антителами к ВПГ-2, ВЭБ и ЦМВ. Механизмы отмеченных влияний антител могут быть связаны с перестройкой нейрональных синапсов, изменением клеточной активности, снижением численности популяций нейронов, а также процессами демиелинизации. Последние нарушают работу ионных каналов и описаны при герпесвирусных инфекциях и шизофрении. Корреляции АСКВП N1-P2 и P2- N2 с уровнем IgG к ВЭБ и ЦМВ могут отражать изменения функционирования мембраны нейронов в слуховой коре под воздействием этих вирусов. Эти же характеристики ВП у больных разных групп коррелируют с такими психопатологическими параметрами, как «подозрительность», «тревога», «общий балл BPRS».
Обращает на себя внимание существенно большая частота выявления изучаемых корреляций в основных группах с более тяжелым течением заболевания по сравнению с контрольной группой рекуррентной шизофрении. Это обстоятельство сопоставимо с ранее описанными нами у пациентов данной выборки закономерностями, обнаруживающими наибольшее число вирусных агентов и их взаимосвязи с основными клиническими симптомами заболевания при более тяжелых формах заболевания [7]. Вместе с тем, хотя число выявленных корреляций в более благоприятной по течению группе рекуррентной шизофрении было минимальным, чаще в них были вовлечены IgМ, отражающие острую раннюю реакцию на инфект. Это обстоятельство находит соответствие с характеристиками клинической картины у больных этой группы, большая острота состояния у которых проявлялась как в бредовых расстройствах, так и в нарушениях поведения (возбуждение, враждебность). Направленность выявленных корреляций у данных пациентов (между ЛСКВП Р1 и уровнем IgG к ВПГ-2, ЛСКВП Р2 и N3 и уровнями IgМ к ВПГ-1) была исключительно отрицательной и свидетельствовала об укорочении латентного периода при увеличении уровня антител. В основных группах с менее благоприятным типом течения заболевания корреляции имели преимущественно положительную направленность, в их числе преобладали корреляции с IgG. Отрицательные корреляции в этих группах связывали уровень противогерпетических антител как с латентностью СВП, так и с амплитудой.
В частности, с латентностью N2 СКВП отрицательно коррелировал уровень IgM к ВПГ-2, с АСКВП P2- N2 и латентностью Р3 ДСВП отрицательно коррелировал уровень IgG к ЦМВ. Роль этих двух вирусов в качестве патогенетических факторов обострения заболевания была нами позиционирована ранее [7, 19]. В целом разнонаправленность корреляций может отражать различные эффекты взаимодействия противовирусных антител с одними и теми же или с разными клеточными рецепторами и возможностью изменения различных видов медиаторного обмена, что приводит как к возбуждению, так и к торможению нейронов.
Таким образом, полученные данные указывают на сопряженность уровня противовирусных антител с нарушением биоэлектрической активности мозга у больных с различными вариантами течения приступообразной шизофрении, что проявляется в аномалиях слуховых когнитивных и длиннолатентных ВП и их связях с клинической симптоматикой. Наиболее отчетливой отмеченная сопряженность является при менее благоприятных вариантах течения заболевания. При благоприятном рекуррентном течении представленность герпес-вирусов и их взаимосвязи со слуховыми ВП выявляются в значительно меньшей степени, однако отражают большую остроту процесса, вероятно, связанную с большей иммунологической реактивностью. Установленные корреляции демонстрируют влияния герпетической инфекции на цингулярную извилину и корковый отдел слухового анализатора, а также ее вовлеченность в механизмы развития аномалий ВП при шизофрении. Они также свидетельствуют о вкладе герпес-вирусов в нарушения когнитивных функций у данного контингента больных.
Литература
1. Алимбарова Л. М., Гараев М. М. Лабораторные методы диагно- стики герпесвирусных инфекций // Актуальные проблемы герпес- вирусных инфекций / Под ред. Д. К. Львова, И. Ф. Баринского, М. М. Гараева, Л. М. Алимбаровой. Москва: ММА им. И. М. Сеченова, 2004. C. 25−29.
2. Колкер И. А. Слуховые вызванные потенциалы в неврологии.// Международный неврологический журнал, 2006. Т. 6, № 10. http:// www. mif-ua.com/archive/article_print/2343
3. Костандов Э. А., Захарова Н. Н., Рещикова Т. Н. и др. Нарушение механизма селекции внимания у больных шизофренией // Журн. невропатол. и психиатр. 1993. № 4. С. 55−58.
4. Лебедева И. С., Каледа В. Г, Абрамова Л. И. и соавт. Нейрофи- зиологические аномалии в парадигме Р300 как эндофенотипы шизофрении // Журн. невропатол. и психиатр. 2008. Т. 108, № 1. С. 61−70.
5. Лебедева И. С., Орлова В. А. Взаимосвязи между Р300 и шириной боковыхжелудочков мозга у больных шизофренией и их родствен- ников. // Физиология человека. 2003. Т. 39, № 6. С. 101−104.
6. Лебедева И. С., Орлова В. А., Каледа В. Г. и др. Слуховые вызванные потенциалы Р300 при шизофрении // Журн. невро- патол. и психиатр. 2000. Т. 100, № 11. С. 47−49. 7. Михайлова И. М., Орлова В. А., Минутко В. Л. и др. Взаимосвязи клинической симптоматики и уровня сывороточных антител к герпесвирусам у больных разными формами шизофрении. // Российский психиатрический журнал, 2014. № 3. С. 61−66. 8. Полетаев А. Б. О «трудных вопросах» аутоиммунитета, или как концепция иммункулуса может стать основой профилактической
7. Михайлова И. М., Орлова В. А., Минутко В. Л. и др. Взаимосвязи клинической симптоматики и уровня сывороточных антител к герпесвирусам у больных разными формами шизофрении. // Российский психиатрический журнал, 2014. № 3. С. 61−66.
8. Полетаев А. Б. О «трудных вопросах» аутоиммунитета, или как концепция иммункулуса может стать основой профилактической медицины // Медицина XXI век. 2008. № 2. С. 84−91.
9. Савина Т. Д, Лебедева И. С Орлова В. А. и соавт. Особенности внимания в семьях больных шизофренией: сопряженность экспе- риментально-психологических и нейрофизиологических данных // Журн. невропатол. и психиатр. 2005. № 3. C. 35−39.
10. Слуховые вызванные потенциалы. www.mediasphera.ru/ uppic/vestn%20otorinolaringol/2009/3/5/lor_200903_05.pdf
11. Bechter K., Reiber H., Herzog S. et al. Cerebrospinal fl uid analysis in affective and schizophrenic spectrum disorders: identifi cation of subgroups with immune responses and blood-CSF barrier dysfunction // J. Psychiatr. Res. 2010. Vol. 44. P. 321−330.
12. Вrаmоn E., Rabe-Hesketh S., Sham P. et al. Meta-analysis of the P300 and P50 waveforms in schizophrenia // Schizoph. Res. 2004. Vol. 70, N 2−3. P. 315−329.
13. Domjan N, Csifcsak G., Drotos G. et al. Different patterns of auditory information processing defi cits in chronic schizophrenia and bipolar disorder with psychotic features // Schizophr Res., 2012. Vol.139, N 1−3. P. 253−259.
14. Goodin D.S., Squires K.C., Henderson B. et.al. Age-related variations in evoked potentials to auditory stimuli in normal human subjects // EEG Clin. Neurophysiol. 1978. Vol. 44. P. 447−458. 15. Hsieh M.H., Shan J.C., Huang W.L. et al. Auditory event-related potential of subjects with suspected pre-psychotic state and fi rstepisode psychosis // Schizophr Res. 2012. Vol. 140, N 1−3. P. 243−249.
15. Hu L., Boutros N.N., Jansen B.H. Sensory gating-out and gating-in in normal and schizophrenic participants. //Clin EEG Neurosci., 2012. — Vol. 43, N1.- P. 23−31.
16. Huang M.W., Chou F.H., Lo P.Y. et al. A comparative study on longterm evoked auditory and visual potential responses between schizophrenic patients and normal subjects // BMC Psychiatry. 2011. Vol. 4, N 11. P. 74−79.
17. Mathalon D., Ford J., Pfefferbaum A. Trait and state aspects of P300 amplitude reduction in schizophrenia: a retrospective longitudinal study // Biol. Psychiatr. 2000. Vol. 47, N 5. P. 434−449.
18. Mikhaylova I., Orlova V., Minutko V. et al. Parameters of Nonspecifi c and Specifi c Immune Resistance in Episodic Remittent Paranoid Schizophrenia Compared with Unfavorably Current Form of Episodic Paranoid Schizophrenia //Int. J. BioMedicine. 2013. Vol. 3, N 4. P. 251−257.
19. Orlova V.A., MikhailovaI.I., Minutko V.L. et al. Abnormalities in the content of serum autoantibodies to the antigens of nervous tissue in patients with schizophrenia. In: «ZPRÁVY VĚDECKÉ IDEJE — 2013» Praha: Publishing House «Education and Science», 2013. P. 29. -33.
20. Prasad K.M., Eack S.M., Goradia D. et al. Progressive gray matter loss and changes in cognitive functioning associated with exposure to herpes simplex virus 1 in schizophrenia: a longitudinal study // Am. J. Psychiatry. 2011. Vol. 168, N 8. P. 822−830.
21. Polich J.P. 300 in clinical applications: meaning, method and measurement // Am. J EEG Technol.1991. N 31. P. 201−230. 22. Shirts B.H., Prasad K.M., Pogue-Geile M.F. et al. Antibodies to cytomegalovirus and Herpes Simplex Virus 1 associated with cognitive function in schizophrenia // Schizophr. Res. 2008. Vol.106, N 2−3. P. 268−274.
23. Yolken R.H., Torrey E.F., Lieberman J.A. et al. Serological evidence of exposure to Herpes Simplex Virus type 1 is associated with cognitive defi cits in the CATIE schizophrenia sample // Schizophr. Res. 2011. Vol. 128, N 1−3. P. 61−65.
